A continuació vos deixare uns quants links de diverses pàgines per a que pugau repasar la formulació i la nomenclatura.
http://www.eis.uva.es/~qgintro/nomen/nomen.html
http://www.alonsoformula.com/inorganica/ejercicios.htm
http://www.juntadeandalucia.es/averroes/galileo/centro/departamentos/fisica/quimica0/ejercicio_formulacion.htm
http://ejercicios-fyq.com/Formulacion_Inorganica/3_ejercicios_de_formulacin_y_nomenclatura.html
miércoles, noviembre 18, 2015
martes, noviembre 17, 2015
LES OXOSALS
Les oxosals són compostos ternaris o quaternaris.
S'otenen al subtituir els àtoms d'hidrògen del àcids oxoàcids total o parcialment per àtoms de metalls
Per a formular cal canviar el simbol H pel simbol del metall (sense canviar el subíndex), i la seua valencia col.locarla com a subíndex de la resta de l'àcid.
Nomenclatura: Emprarem el nom del àcid sense la paraula àcid i cambiant els sufixos per aquestos altres -ic = -at -ós = it + de + M (si cal posem la valencia en parèntesis i amb números romans)
Exemples:
H N O3 - Àcid nítric / K N O3 - Nitrat de Potassi
H Cl O - Àcid hipoclorós / Fe (Cl O)3 - Hipoclorit de Ferro
S'otenen al subtituir els àtoms d'hidrògen del àcids oxoàcids total o parcialment per àtoms de metalls
Per a formular cal canviar el simbol H pel simbol del metall (sense canviar el subíndex), i la seua valencia col.locarla com a subíndex de la resta de l'àcid.
Nomenclatura: Emprarem el nom del àcid sense la paraula àcid i cambiant els sufixos per aquestos altres -ic = -at -ós = it + de + M (si cal posem la valencia en parèntesis i amb números romans)
Exemples:
H N O3 - Àcid nítric / K N O3 - Nitrat de Potassi
H Cl O - Àcid hipoclorós / Fe (Cl O)3 - Hipoclorit de Ferro
lunes, noviembre 16, 2015
ELS OXOÀCIDS
Els oxoàcids són compostos ternaris formats per àtoms d'un element no metal.lic, d'oxigen i d'hidrògen.
La seua fòrmula general és : Hx E Oy
Però també la podem obtindre afegint al òxid la fòrmula de l'aigua
Ejemple: Cl2 O7 + H2 O = H2 Cl2 O8 = H Cl O4
Els oxoàcids es nombren amb la nomenclatura tradicional, que seria la paraula àcid + NM (amb prefixos i sufixos)

La seua fòrmula general és : Hx E Oy
Però també la podem obtindre afegint al òxid la fòrmula de l'aigua
Ejemple: Cl2 O7 + H2 O = H2 Cl2 O8 = H Cl O4
Els oxoàcids es nombren amb la nomenclatura tradicional, que seria la paraula àcid + NM (amb prefixos i sufixos)

viernes, noviembre 13, 2015
ELS ÒXIDS
Els òxids són compostos binaris formats al unir qualquier element químic amb el oxigen.
Fòrmula - Metall + Oxigen (amb valècia -2) (es cruçen les valències) (de vegades es simplifiquen)
En la fòrmula sempre hi haurà que posar-li un dos al metall i al oxigen li posarem la valència del metall, amb l'exepció de que les valències es puguen simplificar.
IUPAC - Llegim la fòrmula del reves i utilitzem els seguents prefixes:
1 = / 2= di 3=tri 4=tetra 5=penta...
ejemple: K2O = Òxid de dipotassi
CaO = Òxid de calci
STOCK - Si tenen més d'una valència la posarem entre parentesis i en números romans.
ejermple: K2O = Òxid de Potassi
CaO = Òxid de Calci
Fòrmula - Metall + Oxigen (amb valècia -2) (es cruçen les valències) (de vegades es simplifiquen)
En la fòrmula sempre hi haurà que posar-li un dos al metall i al oxigen li posarem la valència del metall, amb l'exepció de que les valències es puguen simplificar.
IUPAC - Llegim la fòrmula del reves i utilitzem els seguents prefixes:
1 = / 2= di 3=tri 4=tetra 5=penta...
ejemple: K2O = Òxid de dipotassi
CaO = Òxid de calci
STOCK - Si tenen més d'una valència la posarem entre parentesis i en números romans.
ejermple: K2O = Òxid de Potassi
CaO = Òxid de Calci
jueves, noviembre 12, 2015
LES SALS BINARIES
Les sals binaries són compostos químics formats per àtoms de soles dos elements, més específicament per àtoms d'un metall i un no metall.
Per a nombrar una sal binaria sempre al no metall li afegirem el sufixe -ur, la preposició de i a continuació el nom del metall i el seu numero de valencia
Fòrmula - NM-ur + de + M + nº valència (s'intercambien les valències)
Noms genèrics de les principals sals binaries:
F - Fluorur
P - Fosfur
S - Sulfur
Br - Bromur
N - Nitrur
C - Carbur
Cl - Clorur
IUPAC - Llegim la fòrmula del reves i utilitzem els seguents prefixes:
1 = / 2= di 3=tri 4=tetra 5=penta...
ejemple: CuCl2 = Diclorur de Coure
Ni2S3 = Trisulfur de diniquel
STOCK - Si tenen més d'una valència la posarem entre parentesis i en números romans.
ejermple: CuCl2 = Clorur de Coure (II)
Ni2S3 = Sulfur de Niquel (III)
Alguns compostos tenem noms especials com:
Ca O = Calç viva
Fe2 03 = Rovell
Mg O = Magnèsia
Per a nombrar una sal binaria sempre al no metall li afegirem el sufixe -ur, la preposició de i a continuació el nom del metall i el seu numero de valencia
Fòrmula - NM-ur + de + M + nº valència (s'intercambien les valències)
Noms genèrics de les principals sals binaries:
F - Fluorur
P - Fosfur
S - Sulfur
Br - Bromur
N - Nitrur
C - Carbur
Cl - Clorur
IUPAC - Llegim la fòrmula del reves i utilitzem els seguents prefixes:
1 = / 2= di 3=tri 4=tetra 5=penta...
ejemple: CuCl2 = Diclorur de Coure
Ni2S3 = Trisulfur de diniquel
STOCK - Si tenen més d'una valència la posarem entre parentesis i en números romans.
ejermple: CuCl2 = Clorur de Coure (II)
Ni2S3 = Sulfur de Niquel (III)
Alguns compostos tenem noms especials com:
Ca O = Calç viva
Fe2 03 = Rovell
Mg O = Magnèsia
miércoles, noviembre 11, 2015
ELS HIDRÒXIDS
Els hidròxids són un grup de compostos químic formats per un metall i un o mes ions hidròxils.
Fòrmula - Metall + (OH) (es cruçen les valècies)
Si la valència del metall es 1 els parèntesis s'eliminen, no s'hi posa subíndex
IUPAC - Llegim la fòrmula del reves i utilitzem els seguents prefixes:
1 = / 2= di 3=tri 4=tetra 5=penta...
ejemple: Li (OH) = Hidròxid de Liti
Cu (OH)2 = Dihidròxid de Coure
STOCK - Si tenen més d'una valència la posarem entre parentesis i en números romans.
ejermple: Li (OH) = Hidròxid de Liti
Cu (OH)2 = Hidròxid de Coure (II)
Fòrmula - Metall + (OH) (es cruçen les valècies)
Si la valència del metall es 1 els parèntesis s'eliminen, no s'hi posa subíndex
IUPAC - Llegim la fòrmula del reves i utilitzem els seguents prefixes:
1 = / 2= di 3=tri 4=tetra 5=penta...
ejemple: Li (OH) = Hidròxid de Liti
Cu (OH)2 = Dihidròxid de Coure
STOCK - Si tenen més d'una valència la posarem entre parentesis i en números romans.
ejermple: Li (OH) = Hidròxid de Liti
Cu (OH)2 = Hidròxid de Coure (II)
martes, noviembre 10, 2015
ELS HIDRURS
Els hidrurs són compostos formats per àtoms d'hidrògen i de qualquier altre element químic, té igual que siga metall que no metall. Hi han dos tipus de hidrurs:
IUPAC - Llegim la fòrmula del reves i utilitzem els seguents prefixes:
1 = / 2= di 3=tri 4=tetra 5=penta...
ejemple: CaH2 = Dihidrur de Calci
FeH3 = Trihidrur de Ferro
STOCK - Si tenen més d'una valència la posarem entre parentesis i en números romans.
ejermple: CaH2 = Hidrur de Calci
FeH3 = Hidrur de Ferro (III)
NH3 - Amoniac
PH3 - Fosfina
AsH3 - Arsina
SbH3 - Estibina
CH4 - Metà
SiH4 - Silà
HF - Àcid fluorhídric
HCl - Àcid clorhídric
HBr - Àcid bromhídric
HI - Àcid iohídric
H2S - Àcid sulfúric
H2Se - Àcid selenhídric
H2Te - Àcid telurhídric
- HIDRURS METAL.LICS
IUPAC - Llegim la fòrmula del reves i utilitzem els seguents prefixes:
1 = / 2= di 3=tri 4=tetra 5=penta...
ejemple: CaH2 = Dihidrur de Calci
FeH3 = Trihidrur de Ferro
STOCK - Si tenen més d'una valència la posarem entre parentesis i en números romans.
ejermple: CaH2 = Hidrur de Calci
FeH3 = Hidrur de Ferro (III)
- HIDRURS NO METAL.LICS
NH3 - Amoniac
PH3 - Fosfina
AsH3 - Arsina
SbH3 - Estibina
CH4 - Metà
SiH4 - Silà
HF - Àcid fluorhídric
HCl - Àcid clorhídric
HBr - Àcid bromhídric
HI - Àcid iohídric
H2S - Àcid sulfúric
H2Se - Àcid selenhídric
H2Te - Àcid telurhídric
jueves, noviembre 05, 2015
LES VALÈNCIES
Les valències són el nombre d'electrons que té un element en el seu últim nivell d'energia, es a dir, es la paraula que identifica a la xifra que diu les possibilitats de combinacions que te un àtom respecte a altres per a produir un compost. Necessitem aprendre de memòria les valències per a poder formular i nomenclar.
A conituacio podreu vore la taula de les valències, que es separen en metalls i no metalls.
METALLS NO METALLS
Element
|
Símbol
|
València
|
Liti
Sodi
Potassi
Rubidi
Cesi
Franci
Plata
Amoni
|
Li
Na
K
Rb
Cs
Fr
Ag
NH4 +
|
+1
|
Berili
Magnesi
Calci
Estronci
Bari
Radi
Zinc
Cadmi
|
Be
Mg
Ca
Sr
Ba
Ra
Zn
Cd
|
+2
|
Alumini
|
Al
|
+3
|
Coure
Mercuri
|
Cu
Hg
|
+1,+2
|
Or
|
Au
|
+1,+3
|
Niquel
Cobalt
Ferro
|
Ni
Co
Fe
|
+2+3
|
Platino
Plom
Estany
|
Pt
Pb
Sn
|
+2+4
|
Crom
|
Cr
|
+2+3+6
|
Manganés
|
Mn
|
+2+3+4+6+7
|
Element
|
Símbol
|
València
|
Hidrògen
Flúor
|
H
F
|
-1 +1
|
Clor
Brom
Iode
|
Cl
Br
I
|
-1 +1,+3,+5,+7
|
Azufre
Seleni
Teluri
|
S
Se
Te
|
-2 +2,+4,+6,
|
Nitrògen
Fósfor
Arsénic
Antimoni
|
N
P
As
Sb
|
-3 +1,+3,+5
|
Carboni
Silici
|
C
Si
|
-4 +2,+4
|
Bor
|
B
|
-3 +3
|
Oxígen
|
O
|
-2 (-1)
|
martes, noviembre 03, 2015
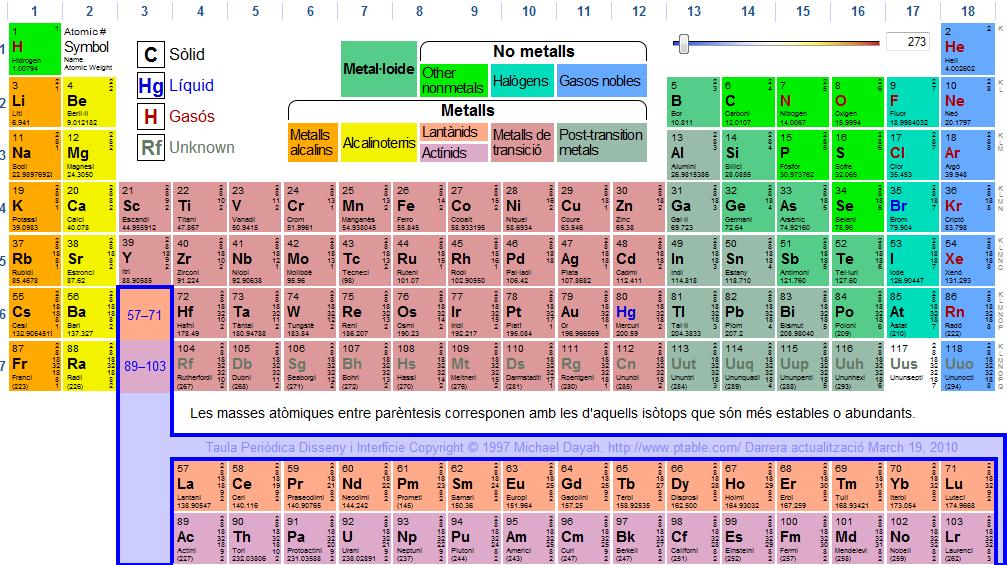
LA TAULA PERIÒDICA
La taula periòdica es un esquema del elements ordenats per el nombre àtomic creixent.
Els elements es troben ordenats en 7 files, anomenades periods, i en 18 columnes anomenades grups.
Segons la seua afinitat els elements de la taula s'han distribuit en: alcalins, alcalinoterris, terris, carbonoides, nitrogenoides, calcògens, alògens i gasos nobles.
lunes, noviembre 02, 2015
LA MATÈRIA
La matèria es tot allò que té massa i volum. Per ejemple un llibre, unes sabates o l'aigua són matèria ja que es poden pesar i ocupen un espai.
Està formada per àtoms, que son la menor cantitat d'un element químic.
L'àtom
L'àtom
- Constituit per un nucli, on es troben els protons i els neutrons, i per una escorça, on es troben els electrons.
- Quan el nombre de protons del nucli es el mateix que el de electrons a l'escorça, dien que l'àtom és neutre.
- El nombre atòmic es el nombre de protons que existeixen al nucli de làtom d'un element.
Les substàncies que formen la matèria es poden classificar en:
- Elements: Substàncies constituides per àtoms iguals. Per ejemple: ferro, higrògen, or, carboni...
- Compostos:Constituits per àtoms diferents. Per ejemple NH3, CO2, H20...
- Mescles: Combinació de dos o més substàncies que poden ser elements o compostos.
Suscribirse a:
Comentarios (Atom)