El segon trimestre ja ha començat i igual que d'açi poc nem a canviar d'any també ens han dit si deuriem canviar alguna cosa de la forma de donar la classe.
Jo pense que la forma de explicar i de donar la classe és la ideal, en canvi pense que el problema que hi ha hagut al primer trimestre ha sigut culpa nostra perque ens pensabem que tots anàvem a traure bones notes sense fer ningún esforç, o posant-se a estudiar la nit d'abans, i les coses no son aixina, si tu vols traure bona nota, hauràs de treballar des de el primer dia, sobre tot si al primer any de batxiller has de cursar la assignatura de física i química, com és el meu cas.
Crec que el que hem de fer tots aquest segons trimestre és intentar traure les millors notes possibles i no deixar-se les coses per a la semana d'abans, si no fen't-les dia a dia.
Jo, personalment, aquest triestre vaig a estar més atenta a les classes, preguntare els dubtes, no em distrauré tant, etc.
miércoles, diciembre 23, 2015
miércoles, noviembre 18, 2015
Ejercicis
A continuació vos deixare uns quants links de diverses pàgines per a que pugau repasar la formulació i la nomenclatura.
http://www.eis.uva.es/~qgintro/nomen/nomen.html
http://www.alonsoformula.com/inorganica/ejercicios.htm
http://www.juntadeandalucia.es/averroes/galileo/centro/departamentos/fisica/quimica0/ejercicio_formulacion.htm
http://ejercicios-fyq.com/Formulacion_Inorganica/3_ejercicios_de_formulacin_y_nomenclatura.html
http://www.eis.uva.es/~qgintro/nomen/nomen.html
http://www.alonsoformula.com/inorganica/ejercicios.htm
http://www.juntadeandalucia.es/averroes/galileo/centro/departamentos/fisica/quimica0/ejercicio_formulacion.htm
http://ejercicios-fyq.com/Formulacion_Inorganica/3_ejercicios_de_formulacin_y_nomenclatura.html
martes, noviembre 17, 2015
LES OXOSALS
Les oxosals són compostos ternaris o quaternaris.
S'otenen al subtituir els àtoms d'hidrògen del àcids oxoàcids total o parcialment per àtoms de metalls
Per a formular cal canviar el simbol H pel simbol del metall (sense canviar el subíndex), i la seua valencia col.locarla com a subíndex de la resta de l'àcid.
Nomenclatura: Emprarem el nom del àcid sense la paraula àcid i cambiant els sufixos per aquestos altres -ic = -at -ós = it + de + M (si cal posem la valencia en parèntesis i amb números romans)
Exemples:
H N O3 - Àcid nítric / K N O3 - Nitrat de Potassi
H Cl O - Àcid hipoclorós / Fe (Cl O)3 - Hipoclorit de Ferro
S'otenen al subtituir els àtoms d'hidrògen del àcids oxoàcids total o parcialment per àtoms de metalls
Per a formular cal canviar el simbol H pel simbol del metall (sense canviar el subíndex), i la seua valencia col.locarla com a subíndex de la resta de l'àcid.
Nomenclatura: Emprarem el nom del àcid sense la paraula àcid i cambiant els sufixos per aquestos altres -ic = -at -ós = it + de + M (si cal posem la valencia en parèntesis i amb números romans)
Exemples:
H N O3 - Àcid nítric / K N O3 - Nitrat de Potassi
H Cl O - Àcid hipoclorós / Fe (Cl O)3 - Hipoclorit de Ferro
lunes, noviembre 16, 2015
ELS OXOÀCIDS
Els oxoàcids són compostos ternaris formats per àtoms d'un element no metal.lic, d'oxigen i d'hidrògen.
La seua fòrmula general és : Hx E Oy
Però també la podem obtindre afegint al òxid la fòrmula de l'aigua
Ejemple: Cl2 O7 + H2 O = H2 Cl2 O8 = H Cl O4
Els oxoàcids es nombren amb la nomenclatura tradicional, que seria la paraula àcid + NM (amb prefixos i sufixos)

La seua fòrmula general és : Hx E Oy
Però també la podem obtindre afegint al òxid la fòrmula de l'aigua
Ejemple: Cl2 O7 + H2 O = H2 Cl2 O8 = H Cl O4
Els oxoàcids es nombren amb la nomenclatura tradicional, que seria la paraula àcid + NM (amb prefixos i sufixos)

viernes, noviembre 13, 2015
ELS ÒXIDS
Els òxids són compostos binaris formats al unir qualquier element químic amb el oxigen.
Fòrmula - Metall + Oxigen (amb valècia -2) (es cruçen les valències) (de vegades es simplifiquen)
En la fòrmula sempre hi haurà que posar-li un dos al metall i al oxigen li posarem la valència del metall, amb l'exepció de que les valències es puguen simplificar.
IUPAC - Llegim la fòrmula del reves i utilitzem els seguents prefixes:
1 = / 2= di 3=tri 4=tetra 5=penta...
ejemple: K2O = Òxid de dipotassi
CaO = Òxid de calci
STOCK - Si tenen més d'una valència la posarem entre parentesis i en números romans.
ejermple: K2O = Òxid de Potassi
CaO = Òxid de Calci
Fòrmula - Metall + Oxigen (amb valècia -2) (es cruçen les valències) (de vegades es simplifiquen)
En la fòrmula sempre hi haurà que posar-li un dos al metall i al oxigen li posarem la valència del metall, amb l'exepció de que les valències es puguen simplificar.
IUPAC - Llegim la fòrmula del reves i utilitzem els seguents prefixes:
1 = / 2= di 3=tri 4=tetra 5=penta...
ejemple: K2O = Òxid de dipotassi
CaO = Òxid de calci
STOCK - Si tenen més d'una valència la posarem entre parentesis i en números romans.
ejermple: K2O = Òxid de Potassi
CaO = Òxid de Calci
jueves, noviembre 12, 2015
LES SALS BINARIES
Les sals binaries són compostos químics formats per àtoms de soles dos elements, més específicament per àtoms d'un metall i un no metall.
Per a nombrar una sal binaria sempre al no metall li afegirem el sufixe -ur, la preposició de i a continuació el nom del metall i el seu numero de valencia
Fòrmula - NM-ur + de + M + nº valència (s'intercambien les valències)
Noms genèrics de les principals sals binaries:
F - Fluorur
P - Fosfur
S - Sulfur
Br - Bromur
N - Nitrur
C - Carbur
Cl - Clorur
IUPAC - Llegim la fòrmula del reves i utilitzem els seguents prefixes:
1 = / 2= di 3=tri 4=tetra 5=penta...
ejemple: CuCl2 = Diclorur de Coure
Ni2S3 = Trisulfur de diniquel
STOCK - Si tenen més d'una valència la posarem entre parentesis i en números romans.
ejermple: CuCl2 = Clorur de Coure (II)
Ni2S3 = Sulfur de Niquel (III)
Alguns compostos tenem noms especials com:
Ca O = Calç viva
Fe2 03 = Rovell
Mg O = Magnèsia
Per a nombrar una sal binaria sempre al no metall li afegirem el sufixe -ur, la preposició de i a continuació el nom del metall i el seu numero de valencia
Fòrmula - NM-ur + de + M + nº valència (s'intercambien les valències)
Noms genèrics de les principals sals binaries:
F - Fluorur
P - Fosfur
S - Sulfur
Br - Bromur
N - Nitrur
C - Carbur
Cl - Clorur
IUPAC - Llegim la fòrmula del reves i utilitzem els seguents prefixes:
1 = / 2= di 3=tri 4=tetra 5=penta...
ejemple: CuCl2 = Diclorur de Coure
Ni2S3 = Trisulfur de diniquel
STOCK - Si tenen més d'una valència la posarem entre parentesis i en números romans.
ejermple: CuCl2 = Clorur de Coure (II)
Ni2S3 = Sulfur de Niquel (III)
Alguns compostos tenem noms especials com:
Ca O = Calç viva
Fe2 03 = Rovell
Mg O = Magnèsia
miércoles, noviembre 11, 2015
ELS HIDRÒXIDS
Els hidròxids són un grup de compostos químic formats per un metall i un o mes ions hidròxils.
Fòrmula - Metall + (OH) (es cruçen les valècies)
Si la valència del metall es 1 els parèntesis s'eliminen, no s'hi posa subíndex
IUPAC - Llegim la fòrmula del reves i utilitzem els seguents prefixes:
1 = / 2= di 3=tri 4=tetra 5=penta...
ejemple: Li (OH) = Hidròxid de Liti
Cu (OH)2 = Dihidròxid de Coure
STOCK - Si tenen més d'una valència la posarem entre parentesis i en números romans.
ejermple: Li (OH) = Hidròxid de Liti
Cu (OH)2 = Hidròxid de Coure (II)
Fòrmula - Metall + (OH) (es cruçen les valècies)
Si la valència del metall es 1 els parèntesis s'eliminen, no s'hi posa subíndex
IUPAC - Llegim la fòrmula del reves i utilitzem els seguents prefixes:
1 = / 2= di 3=tri 4=tetra 5=penta...
ejemple: Li (OH) = Hidròxid de Liti
Cu (OH)2 = Dihidròxid de Coure
STOCK - Si tenen més d'una valència la posarem entre parentesis i en números romans.
ejermple: Li (OH) = Hidròxid de Liti
Cu (OH)2 = Hidròxid de Coure (II)
martes, noviembre 10, 2015
ELS HIDRURS
Els hidrurs són compostos formats per àtoms d'hidrògen i de qualquier altre element químic, té igual que siga metall que no metall. Hi han dos tipus de hidrurs:
IUPAC - Llegim la fòrmula del reves i utilitzem els seguents prefixes:
1 = / 2= di 3=tri 4=tetra 5=penta...
ejemple: CaH2 = Dihidrur de Calci
FeH3 = Trihidrur de Ferro
STOCK - Si tenen més d'una valència la posarem entre parentesis i en números romans.
ejermple: CaH2 = Hidrur de Calci
FeH3 = Hidrur de Ferro (III)
NH3 - Amoniac
PH3 - Fosfina
AsH3 - Arsina
SbH3 - Estibina
CH4 - Metà
SiH4 - Silà
HF - Àcid fluorhídric
HCl - Àcid clorhídric
HBr - Àcid bromhídric
HI - Àcid iohídric
H2S - Àcid sulfúric
H2Se - Àcid selenhídric
H2Te - Àcid telurhídric
- HIDRURS METAL.LICS
IUPAC - Llegim la fòrmula del reves i utilitzem els seguents prefixes:
1 = / 2= di 3=tri 4=tetra 5=penta...
ejemple: CaH2 = Dihidrur de Calci
FeH3 = Trihidrur de Ferro
STOCK - Si tenen més d'una valència la posarem entre parentesis i en números romans.
ejermple: CaH2 = Hidrur de Calci
FeH3 = Hidrur de Ferro (III)
- HIDRURS NO METAL.LICS
NH3 - Amoniac
PH3 - Fosfina
AsH3 - Arsina
SbH3 - Estibina
CH4 - Metà
SiH4 - Silà
HF - Àcid fluorhídric
HCl - Àcid clorhídric
HBr - Àcid bromhídric
HI - Àcid iohídric
H2S - Àcid sulfúric
H2Se - Àcid selenhídric
H2Te - Àcid telurhídric
jueves, noviembre 05, 2015
LES VALÈNCIES
Les valències són el nombre d'electrons que té un element en el seu últim nivell d'energia, es a dir, es la paraula que identifica a la xifra que diu les possibilitats de combinacions que te un àtom respecte a altres per a produir un compost. Necessitem aprendre de memòria les valències per a poder formular i nomenclar.
A conituacio podreu vore la taula de les valències, que es separen en metalls i no metalls.
METALLS NO METALLS
Element
|
Símbol
|
València
|
Liti
Sodi
Potassi
Rubidi
Cesi
Franci
Plata
Amoni
|
Li
Na
K
Rb
Cs
Fr
Ag
NH4 +
|
+1
|
Berili
Magnesi
Calci
Estronci
Bari
Radi
Zinc
Cadmi
|
Be
Mg
Ca
Sr
Ba
Ra
Zn
Cd
|
+2
|
Alumini
|
Al
|
+3
|
Coure
Mercuri
|
Cu
Hg
|
+1,+2
|
Or
|
Au
|
+1,+3
|
Niquel
Cobalt
Ferro
|
Ni
Co
Fe
|
+2+3
|
Platino
Plom
Estany
|
Pt
Pb
Sn
|
+2+4
|
Crom
|
Cr
|
+2+3+6
|
Manganés
|
Mn
|
+2+3+4+6+7
|
Element
|
Símbol
|
València
|
Hidrògen
Flúor
|
H
F
|
-1 +1
|
Clor
Brom
Iode
|
Cl
Br
I
|
-1 +1,+3,+5,+7
|
Azufre
Seleni
Teluri
|
S
Se
Te
|
-2 +2,+4,+6,
|
Nitrògen
Fósfor
Arsénic
Antimoni
|
N
P
As
Sb
|
-3 +1,+3,+5
|
Carboni
Silici
|
C
Si
|
-4 +2,+4
|
Bor
|
B
|
-3 +3
|
Oxígen
|
O
|
-2 (-1)
|
martes, noviembre 03, 2015
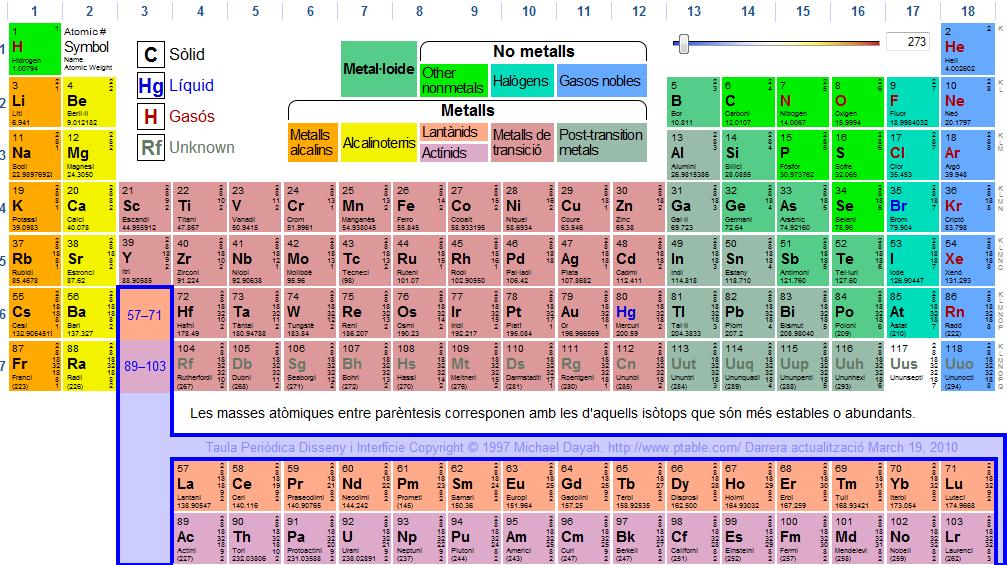
LA TAULA PERIÒDICA
La taula periòdica es un esquema del elements ordenats per el nombre àtomic creixent.
Els elements es troben ordenats en 7 files, anomenades periods, i en 18 columnes anomenades grups.
Segons la seua afinitat els elements de la taula s'han distribuit en: alcalins, alcalinoterris, terris, carbonoides, nitrogenoides, calcògens, alògens i gasos nobles.
lunes, noviembre 02, 2015
LA MATÈRIA
La matèria es tot allò que té massa i volum. Per ejemple un llibre, unes sabates o l'aigua són matèria ja que es poden pesar i ocupen un espai.
Està formada per àtoms, que son la menor cantitat d'un element químic.
L'àtom
L'àtom
- Constituit per un nucli, on es troben els protons i els neutrons, i per una escorça, on es troben els electrons.
- Quan el nombre de protons del nucli es el mateix que el de electrons a l'escorça, dien que l'àtom és neutre.
- El nombre atòmic es el nombre de protons que existeixen al nucli de làtom d'un element.
Les substàncies que formen la matèria es poden classificar en:
- Elements: Substàncies constituides per àtoms iguals. Per ejemple: ferro, higrògen, or, carboni...
- Compostos:Constituits per àtoms diferents. Per ejemple NH3, CO2, H20...
- Mescles: Combinació de dos o més substàncies que poden ser elements o compostos.
miércoles, octubre 28, 2015
Benvinguts!
Hola, el meu nom és Dieba De Oliveira i tinc 15 anys. En aquest blog vuic aconseguir donar a coneixer els meus aprenentatges en la classe de física i química durant tot el curs de 4ºESO. Ací pujaré entrades relacionades amb aquest tema i també posaré videos, imatges, resums, expliacions, etc sobre tot el que vaja aprenent a classe i, a poder ser, ho ampliare amb coses que trobe per pàgines d'internet. En principi putjaré noves entrades totes les setmanes amb la finalitat de aclarir informació i ajudar a aprendre.
Suscribirse a:
Entradas (Atom)